原代细胞分离指直接从活体组织或器官中分离并在体外培养的细胞,保留了与原组织相似的生物学特性和功能。这些细胞在培养中具有有限的增殖能力,但由于其高度的生理相关性,被广泛用于研究细胞生理、疾病机制以及药物筛选等领域。将细胞从组织或器官中提取并进行体外培养的过程。具体步骤包括在无菌条件下获取目标组织,利用酶如胰蛋白酶或胶原酶进行消化,将组织分解成单个细胞悬液,然后通过离心和过滤等方法分离出细胞,最终在适当的培养条件下进行培养。
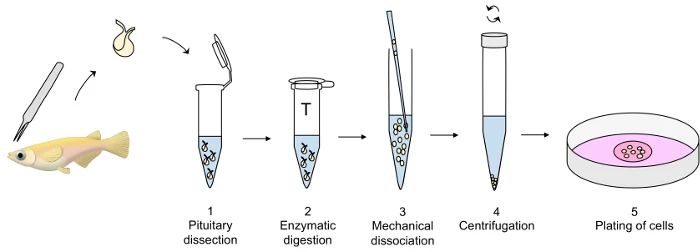
原代细胞的分离是实现原代细胞培养的第一步
原代细胞分离的方法有很多种:悬浮离心法、直接组织块法、酶消化法、非酶消化法、机械分散法等。
1. 机械分离法
机械分离法主要适用于纤维组织和肌肉组织等坚硬组织。其操作步骤为:先将样品用钳子或剪刀细剁成小碎片,再用组织破碎机或匀浆器等器械破碎,使细胞得以自由分散。最后通过滤网将细胞分离。
2. 酶消化法
酶消化法是将组织分解成单个细胞的常用方法。通过选用合适酶的不同浓度、作用时间和温度,可以使不同类型的细胞得到分离。酶消化常用的消化酶有胶原酶、胰蛋白酶、牛血清白蛋白等。
3. 贴壁法
贴壁法主要适用于基质附着型细胞,例如成肌细胞、成纤维细胞等。操作时,将组织切成适当大小的小块,置于培养皿中,加入培养液,经过一段时间后,未附着于基质的细胞会被洗掉,贴着基质的细胞则会继续生长。
4. 悬浮培养法
悬浮培养法适用于以血液为基础的细胞,例如淋巴细胞、白血
细胞等。操作时,将血液加入离心管中,慢慢离心分离淋巴细胞、单核细胞等,最后将上清液转移到新的培养皿中。
分离处理
常规组织处理一般有两种方法,分别是通过物理机械剪切和化学生物酶解来实现细胞分离。
物理机械剪切是使用匀浆机打散组织或者使用剪刀、铜网或者组织研磨器进行的剪碎法、网搓法和研磨法。这种方法成本低,操作简单、快速,但对组织机械损伤巨大,而且细胞分散效果不尽人意,只适用于一些质地软且较为松散的软组织。
化学生物酶解法是组织样本预处理之后,在酶的作用下,破坏组织间的胶原纤维和弹性纤维,同时水解粘多糖及其他连接细胞间的蛋白质;或者通过EDTA等化学物质与细胞上的钙、镁离子结合形成螯合物,利用结合后的机械力使细胞变圆而分散细胞,尤其对上皮组织的分散效果很好。
使用酶解体系进行组织解离时还需注意酶的选择和配比,最常使用胰蛋白酶和胶原酶进行处理。其中胰蛋白酶对蛋白质有水解作用,主要作用于赖氨酸或精氨酸相连接的肽键,使细胞间质中的蛋白质消化溶解而使细胞分散开,适用于多种组织。
胶原酶是一种从细菌中提取出来的酶,对胶原有很强的消化作用。适用于消化纤维性组织、上皮组织以及癌组织,它对细胞间质有较好的消化作用。不同的胶原酶适用的组织也会有不同。
消化分离法的操作步骤
1)剪切把组织块剪碎,呈 1~5mm3 大小的组织块。
2) 加液漂洗 将碎组织块在平皿(或三角烧瓶)中用无钙镁 PBS 洗 2-3 次(采用倾斜,自然沉降法)。
3)消化 加入消化液 (胰蛋白酶或胶原酶或 EDTA )于 37℃水浴中作用适当时间 (中间可轻摇 1~2 次),若组织块膨松呈絮状可终止,若变化不大可更换一次消化液,继续消化直至膨松絮状为止。胰蛋白酶消化时间不宜过长。
4)弃去消化液 采用倾斜自然沉降或低速离心法尽量弃去消化液。
5)漂洗 将含有钙、镁离子的培养基沿瓶壁缓缓加入,中止消化反应,采用漂洗法洗 2-3 次后,加入完全培养基。
6)机械分散 采用吸管吹打或振荡法,使细胞充分散开后用纱网或 3~4 层无菌纱布过滤后分瓶培养,若要求不高可采用倾斜自然沉降 5~10 分钟,吸上层细胞悬液进行分瓶培养。
注意事项如下
1)组织块必须漂洗 2-3 次以除去组织中的钙、镁离子和血清对胰蛋白酶和 EDTA 的抑制作用。
2)胰蛋白浓度不宜过高,作用时间不能太长,以避免毒性作用。
3)消化后组织不仅要尽量弃去消化液,以避免毒性产生,而且动作要轻,以避免膨松的细胞随漂洗而丢失
1)无菌
确保使用无菌设备、试剂和技术收集和处理组织。使用个人防护设备以避免污染。使用0.22微米的膜无菌过滤所有酶和试剂。
2)切块
用无菌剪刀或手术刀将组织标本切成小块(通常为2×4mm),然后将小块放入选定的缓冲液、培养基或盐溶液中。
3)加酶
将组织清洗三次以消除多余的血液蛋白,然后加入您选择的酶如胶原酶、蛋白酶、木瓜蛋白酶或胰蛋白酶。通常,约0.5 mg/ml~1.5mg/ml的酶。
4)孵育
将组织样本在其最佳温度下孵育,通常在37℃下孵育30~90分钟。定期混合或轻轻摇动标本。
5)洗涤
通过轻轻移液来分散细胞(也称为研磨),然后,使用细网过滤细胞悬浮液。让细胞沉淀并滗出多余的含液酶;洗两到三次。含有FBS,BSA或其他抑制剂的洗涤溶液也可用于阻止酶消化。
6)分析
将细胞重悬于正确的培养基或缓冲液中,然后定量测定细胞产量和活力。这是细胞分离过程中的重要步骤,因此您可以评估解离技术的结果。大多数研究人员使用血细胞计数器测定细胞产量,并使用台盼蓝重氮染料测量细胞活力。
7)培养
根据所分离的细胞来选择最适合研究的方案和处理步骤来培养细胞。
在实验操作过程中有以下几点也需要注意:
1.严格无菌操作,快速处理;
2.针对不同组织类型控制环境温度;
3.保证工具锋利,减少机械损伤,动作轻柔,保持组织湿润;
4.尽量去除非相关组织,尤其是残留的小血管等;
5.完整记录组织情况、重量等信息。
拿到样本后针对不同分离流程选择不同的预处理方式(如将肿瘤组织剪切到2-4mm左右的小块),如血液细胞等已经是单细胞悬液的样本在简单的离心换液过后就可以直接使用了,其他类型的组织还需要进一步解离。


